Introduction
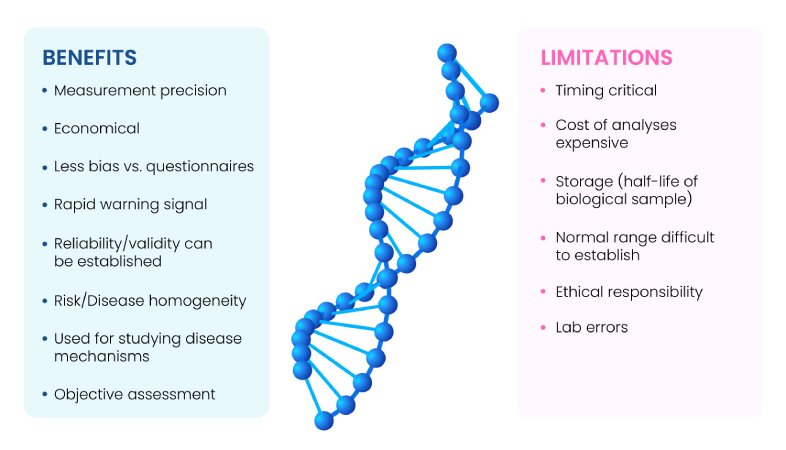
バイオマーカーは、恒常性、疾患状態、あるいは薬理学的介入を示す指標である。理想的なバイオマーカーは binary(存在するか否か)で、組織・細胞・体液、または血糖値や血圧のような単純な生理学的パラメータとして 定量可能、かつ変動が最小限であることが求められる。さらに、signal-to-noise ratio が十分に大きく(高い感度と特異性を備え)、基礎疾患や治療による変化に対して 迅速かつ再現性良く 追随して変動しなければならない。バイオマーカーの主な利点と限界は Fig. 1(1) に要約されている。
Fig 1: Benefits and limitations of Biomarkers
バイオマーカーは biological markers、molecular markers、surrogate endpoints、あるいは signature molecules とも呼ばれ、バイオ製薬、診断、個別化医療をはじめとするヘルスケア産業全体にとって極めて重要である。グローバルなバイオマーカー市場は 2022 年に USD 66.97 billion と評価され、2023–2030 年に CAGR 13.3 % で成長すると予測されている(2)。companion diagnostics の影響拡大、がん・心血管・神経・免疫疾患の発症率/罹患率の上昇、民間および公的部門からの投資・資金提供の増加、現在進行中の R&D から生まれる顕著な発明、さらにデジタルヘルステクノロジーの革新が、バイオマーカー産業の成長を加速・牽引すると見込まれている(2)。
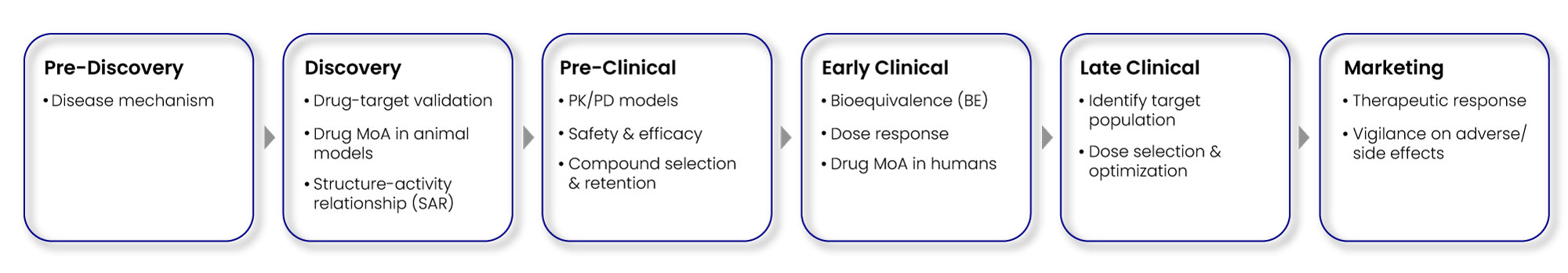
バイオマーカーは Fig. 2 に示すように、創薬初期から前臨床、そして後期の臨床開発に至るまで、幅広い機能を担っている。
Fig 2: Diverse biomarkers in drug discovery & development process
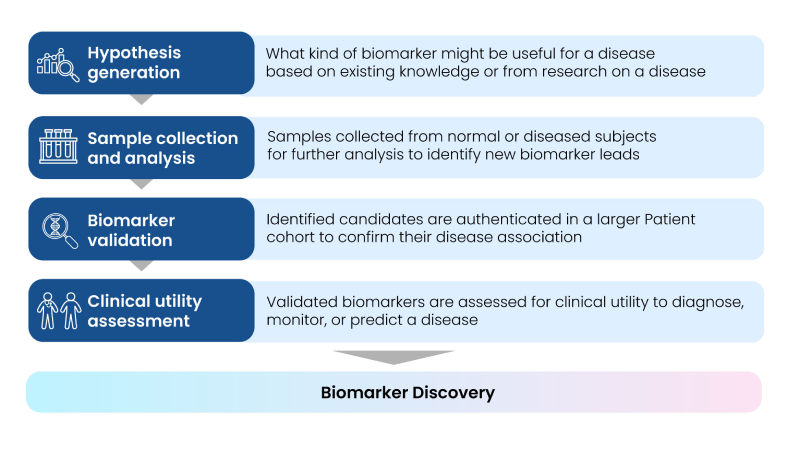
バイオマーカー探索は、生体試料中の タンパク質、ペプチド、ホルモン、DNA/RNA を同定・定量・検証し、各種 R&D に活用できる候補を絞り込むプロセスである。このプロセスは、医薬品の 作用機序 (mechanism of action) を解明し、開発初期における toxicity や efficacy のシグナルを評価し、薬剤の PK/PD を測定し、さらに特定の治療に反応しやすい患者を同定するうえで不可欠である。創薬初期段階では、バイオマーカーが disease-specific な分子経路を明らかにする手がかりにもなる(3)。
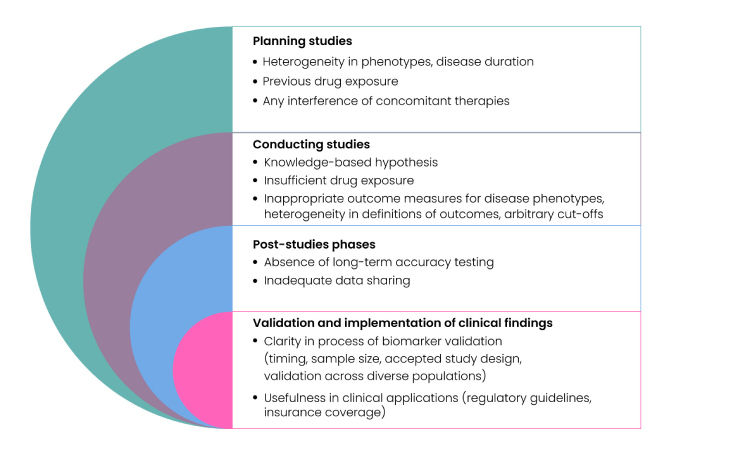
バイオマーカーの discovery、validation、qualification プロセスには多くの課題がある。Fig. 4 に示すように、患者選択・リクルートメントの不備、サンプルサイズの不足、不適切なサンプルハンドリング、metabolomic/proteomic データの不足、不十分な試験デザイン、さらにバイオマーカー測定時の cut-off 値が適切に設定されていないことなどが、主な律速要因となっている。
Fig 4: Challenges in Biomarker Discovery
年齢、人種、性別、ライフスタイルなど 複数の変数 が存在するため、これらの人口統計学的・臨床的要因による直接的な影響と、疾患そのものによる真の影響を識別することは困難である。さらに、バイオマーカー探索プロセスは 時間がかかり、高コストで、リソース集約型 となりがちであり、多様な集団・民族を対象とする大規模試験と長期追跡を要するため、研究資金を十分に確保しにくい。加えて、バイオマーカーアッセイの 精度の限界、標準化手順の欠如、診断精度評価の不備 などが臨床的有用性を曖昧にする要因となる。実際、診断には有用でも、疾患進行のモニタリングや治療反応の予測には適さないバイオマーカーも存在する(5)。
しかし、multi-omics、cytometry、imaging の技術革新と、先進的な bioinformatics/biostatistics 手法を組み合わせることで、従来型バイオマーカー探索が直面する課題の一部を克服し、複雑疾患に対して再現性の高いバイオマーカーの発見・開発 を加速できると期待されている(3)。
Background
バイオマーカーのランドスケープ評価
前節では、バイオマーカー探索の長く険しい道程について述べた。バイオマーカーのランドスケープを評価することは、創薬・開発や疾患検出・モニタリングにおける 機能的・戦略的・商業的インパクト と分類を見極めるうえで不可欠であり、十分な drug-target-disease アソシエーションを確保する必要がある。
診断バイオマーカーは臨床症状が現れる前に疾患を検知できる一方、HER2 の過剰発現/増幅のような予後バイオマーカーは乳癌患者の将来の疾患転帰や全生存率を予測できる。PSA 濃度や Gleason スコアは予測バイオマーカーとして、多様な患者集団における潜在的疾患リスクを示し、治療反応を評価する指標となる。
機能的に異なるバイオマーカーの例は Fig. 5 に示されている。
Fig 5: Functionally distinct biomarker types
bench-to-bedside をつなぐ translational biomarkers は、臨床候補化合物が臓器や組織などの生体システムに与える影響を、具体的な臨床効果が現れる はるか前 に把握するために用いられる。これに対し、臨床試験組み入れ時に使用される safety biomarkers は、特定薬剤による adverse events や toxicity が患者に生じる確率を予測する指標となる。
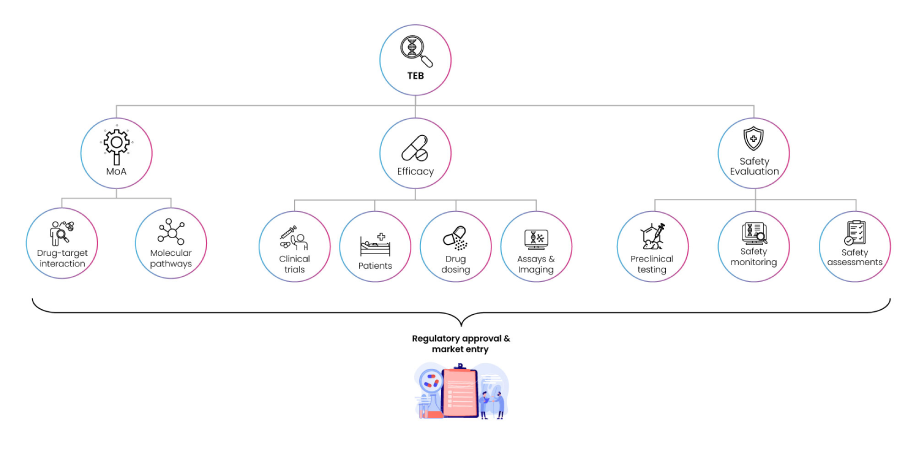
臨床バイオマーカーは、疾患の 診断、進行の モニタリング、適切な患者群での治療方針や 治療反応の予測 まで、バイオマーカー機能の全スペクトルを包含している。なかでも Target engagement biomarkers (TEBs) は、薬剤-標的結合が生物学的応答を引き起こすかどうか、さらに on-/off-target の副作用を最小限に抑えられる 最適用量 がいくつかを確認するために活用される(6)。
Fig 6: Functions of Target Enhancement Biomarkers (TEBs)
TEB は、前臨床段階の 遺伝子改変動物 や xenograft 動物など特定疾患モデルにおいて、有望化合物の in vivo efficacy、safety、drug resistance および PK/PD 特性をモニタリングする (7; 8; 9)(Fig. 6)。さらに mechanistic PK/PD モデルと TEB をリンクさせることで、薬剤作用の基礎メカニズムを解明し、投与量-バイオマーカー応答 の関係を確立できる。これにより、
- dose escalation 試験が応答時間経過へ与える影響
- 応答持続時間と血漿薬物濃度-応答間の ラグタイム
- 反復投与の効果(tolerance, sensitisation, reflex mechanisms)
- 有効な dose range、dose separation、dosing interval
を定量的に評価でき、臨床試験シミュレーションの基盤を形成する。結果として、将来の臨床試験設計における go/no-go 判断をより合理的に行う道が開かれる。
バイオマーカーがどのように機能的に定義・分類されていても、その 開発と応用 は、複数の生理的・病理的状態において fit-for-purpose 原則に基づいて決定されるべきである(3)。
さらに、デジタルトランスフォーメーションの進展と、高性能クラウドコンピューティングやクラウドでのデータ保存・管理・自動化の普及により、AI/ML といった破壊的・革新的テクノロジーが、バイオ医薬品、ヘルスケア製品・サービス、ライフサイエンス研究の価値提案を再定義する新たな時代が到来している。
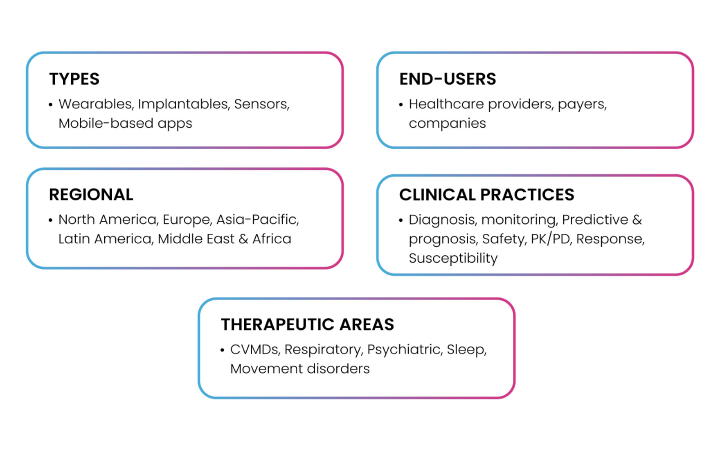
たとえば digital biomarkers は、従来型医療とデジタルヘルス/デジタル治療の「橋渡し」となり得る。COVID-19 パンデミック後は、医療費の急騰、健康アウトカムの悪化、呼吸器・感染症・心血管疾患の増加に加え、mHealth/eHealth、IoT、ウェアラブル技術 の普及・アクセス性向上が重なり、デジタルヘルス実践が急速に拡大した(10)。FDA は digital biomarker を「Digital Health Technologies (DHTs) から収集された特性あるいは特性群であり、正常/病的生物学的過程、また曝露や介入(治療介入を含む)に対する応答の指標として測定されるもの」と定義している。これらのバイオマーカーは、理想的な候補の検出・選抜プロセスを大幅に強化し、population health trends、illness patterns、risk factors、treatment outcomes を可視化する膨大なデータを提供し得る。Biogen、Amgen、Apple、Altoida、AliveCor、GlaxoSmithKline、Kintsugi などが digital biomarker 領域を革新する主要プレイヤーとして知られている。Fig. 7 は、digital biomarkers の市場をタイプ、エンドユーザー、地域、臨床応用、治療領域別に分類した現状セグメンテーションを示す。
Fig 7: Digital Biomarkers Market Segmentation
心拍数、身体活動量、睡眠パターン、体温、血圧、歩数などの 行動・生理データ は、フィットネストラッカーやスマートフォンなどのデジタルウェアラブルデバイス(eHealth/mHealth アプリとソフトウェア、コンピューティングプラットフォーム、インターネット接続、各種センサーを搭載)で取得される。こうしたデータは、有効な digital biomarkers と見なすことができる。Digital Medicine Society は、430 を超える digital endpoints、それを計測するセンサー/デバイス、関連臨床試験情報を網羅したライブラリを整備し、digital biomarker の探索を支援している(11)。
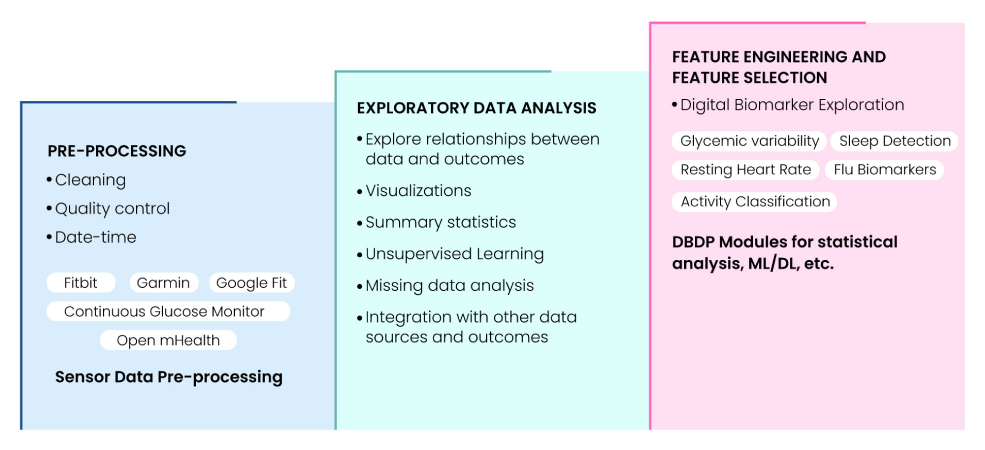
Digital Biomarker Discovery Pipeline (DBDP) は、FAIR 原則に則ったエンドツーエンドの digital biomarker 開発を可能にする、初の包括的オープンソース・ソフトウェアプラットフォームである(12)。DBDP の各モジュールは、resting heart rate (RHR)、glycemic variability、insulin sensitivity status、exercise response、inflammation、heart rate variability、activity、sleep、circadian patterns、flu biomarkers などを計算・活用して健康アウトカムを予測する。さらに Digital Biomarker Discovery Education、Open mHealth と連携した open DBDP、Digital Health Data Repository (DHDR) などのリソースも提供する。Fig. 8 は、DBDP が対応する digital biomarker discovery pipeline の構成要素をまとめたものである。
Fig 8: Digital Biomarker Discovery Pipeline (DBDP) landscape
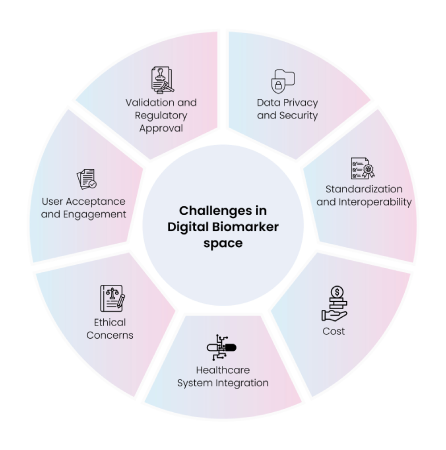
デジタルバイオマーカーへの関心は急速に高まっている一方で、関連する real-world data は入手が容易ではなく、デジタルヘルスデータ解析に必要なツールや技術の効率的な活用を阻んでいる。規制監督の不足、資金調達機会の限界、個人データ共有に対する不信感、オープンソースのデータおよびコードの不足 などが、デジタルバイオマーカー開発の主な課題である。加えて、機微な健康情報を保護し HIPAA や GDPR に準拠させることも不可欠となる。デジタルデータをデジタルバイオマーカーへ変換するプロセスは計算資源を大量に消費し、標準化された検証手法が不足している点も障壁となっている。これらの主要課題は Fig. 9 にまとめられている。
従来型・デジタル型を問わず、バイオマーカーの同定と選択に one-size-fits-all の手法を適用することは必ずしも現実的ではない。データ特異性、開発コスト、プロセスの複雑性、対象範囲、効率、さらにはテクノロジーや分子ツールの radical power を踏まえた 新しいプロファイリング手法 を導入し、活用することが急務となっている(13; 14)。
バイオマーカー探索におけるトレンド/テクノロジー
バイオマーカー探索では 正しい target-disease-drug データの選定 が不可欠だが、未構造化・サイロ化され、FAIR (Findable, Accessible, Interoperable, Reusable) 原則を満たさない膨大なデータが存在することが、従来および最新のメソッド/ツールによる data cleaning、fusion、integration を大きく阻害し、理想的バイオマーカー候補の同定を難しくしている。Fig. 10 では、使用される各種ツールと手法を示し、specificity、efficacy、cost、time、efforts といった指標に対する利点と欠点を比較している。
Fig 10:従来手法と最新手法・ツールの比較
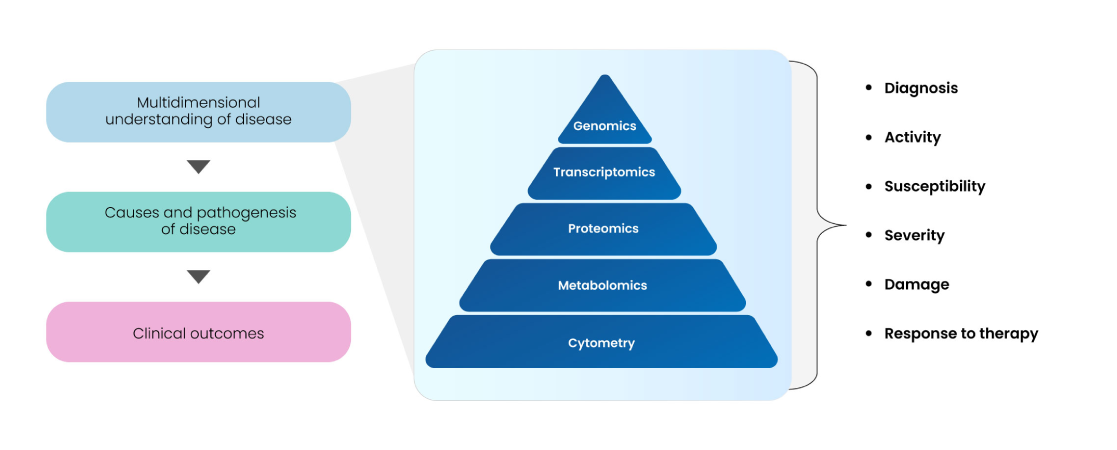
上図が示すとおり、multi-omics、cytometry、imaging は target–disease–drug アソシエーションの多面的解析において現在もっとも有望なテクノロジーであり、multivariate data types、databases、bioinformatics、biostatistic analytical tools と組み合わせることで威力を発揮する。これらがバイオマーカーの discovery と validation に及ぼす影響、疾患生物学の理解を助ける仕組み、そして強固な臨床トランスラタビリティをもたらす過程は Fig. 11 に示されている。
Fig 11: Multi-omics approaches for biomarker discovery and validation
遺伝子変異や多型といった genomic biomarkers、遺伝子または miRNA 発現プロファイリングに基づく transcriptomic biomarkers、allele/haplotype mapping、epigenomics、SNP analysis、pharmacogenomics、proteomics、metabolomics、glycomics、ほか各種 small molecules など、さまざまな分子が良好な健康アウトカムと臨床応用を示すエンドポイントマーカーとなり得る。
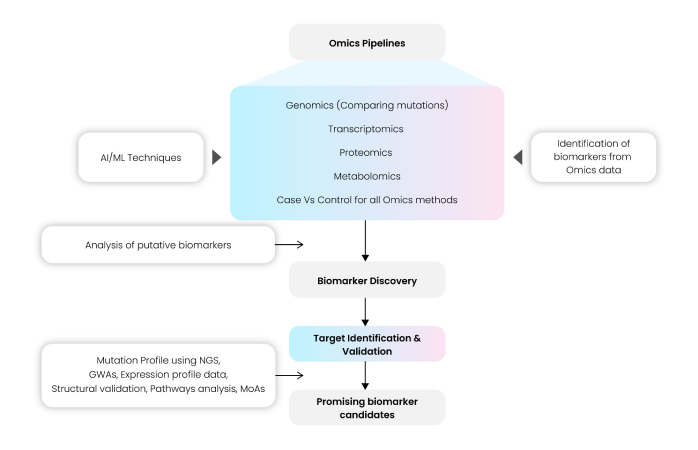
データタイプに応じて multi-omics パイプラインをカスタマイズし、AI/ML アルゴリズムを統合することで、新規ターゲットの発見を促進し、続いてそれらを prospective biomarkers として分類できる。Fig. 12 の schema は、biomarker discovery に用いられる Omics プラットフォームの典型的な workflow を概観している。
このパイプラインには、Phred score、Library size、adapter sequence の有無などを指標とした入力データ(gene expression や proteomic data)の quality control と validation の重要ステップが含まれる。正規化済みデータは後続の processing、downstream analysis、さらに target identification と validation のための statistical methods に使用され、これらは文献で広く採用される standard tools/methods に基づき選択される。
加えて proteomic data を用いて候補分子を検証し、statistical methods と correlation studies を併用する。Mutation profiling、GWAS analysis、pathway analysis、potential mechanisms of action の解析により、最終的な top biomarkers を絞り込むことが可能となる。
しかしこれらのバイオマーカー測定には、statistical methods の制約、data normality と distribution、outliers や未検出バイオマーカーの限界、gene duplications と selection、computational complexity、high-dimensional datasets など、多くの限界が伴う(17)。
Fig 12: Omics pipelines used in Biomarker Discovery
機械学習 (ML) を基盤とする手法の開発により、データ規模の巨大化、多様な分布、非線形性といった課題の一部を克服できる。ML algorithms は大規模データセットからパターンを抽出し、入力データに基づいてアウトカムを予測したり、群を分類したりすることが可能である(17)。
機械学習 (ML) がバイオマーカー探索に与える影響
大規模にアノテーションされた multi-omics データの氾濫と計算能力の飛躍的向上により、創薬初期段階で AI/ML アルゴリズムが本格導入されつつある。AI/ML と deep learning (DL) の急速な進展は、genomic、transcriptomic、proteomic、metabolomic など多様な入力データを用いて、複雑な drug response や resistance を予測することを可能にしている(15)(Fig. 13)。
Fig 13: Input data types used in ML-based biomarker discovery
予測アウトカムは、新規バイオマーカー候補の identification と validation に活用できる。supervised/unsupervised の ML/DL アンサンブルモデルをバイオメディカルデータに適用することで、personalized therapies、drug repurposing、創薬研究、バイオマーカー開発を加速し、手技の現場における意思決定・診断・治療を改善する一助となる(16)。
Fig 14: General ML workflow for biomarker identification
ML ベースのバイオマーカー探索では data pre-processing が極めて重要な初期ステップとなる。前処理済みデータは、その後のモデル構築・学習に適した形式へ変換される(17)。Fig. 14 は、ML アプローチによるバイオマーカー同定で実行される主要工程を概説している。実践で広く採用され、成果を上げている代表的 ML アルゴリズムには、Support Vector Machine (SVM)、Random Forest (RF)、K-Nearest Neighbour (KNN)、Logistic Regression (LR)、Cox regression、LASSO regression、ANOVA、そして Deep Neural Networks などが挙げられる(18)。
薬剤応答予測モデルの学習は、患者が実世界/シミュレーション下で薬剤に示す反応を予測し、それに基づいてバイオマーカー候補を抽出することを目的に、patient-specific features を生成するところから始まる。ML/DL モデル内の scoring algorithm が算出した特徴量は、必要に応じて修正・再評価を行い、患者のクラス割り当てを調整することで、モデルの学習効率を高める。再評価後、疾患サンプルの割合を基準に有望なバイオマーカーをランク付けし、それらが正常サンプルとして分類できるか、または薬効の proxy として機能するかを判定する。学習済み ML/DL モデルは、特徴量の調整やバイオマーカーの差し替えを通じて、正常 vs. 疾患サンプルを高精度で識別できるようにする必要がある。
Validation 段階では、真陽性と予測された biomarker-drug pairs を Genomics of Drug Sensitivity in Cancer (GDSC)、FDA-approved drugs、ClinicalTrials.gov などのリファレンスデータセットにマッピングして検証する。Fig. 15 には、deep learning (DL) を用いたバイオマーカー探索のエンsemble ワークフロー全体が示されている。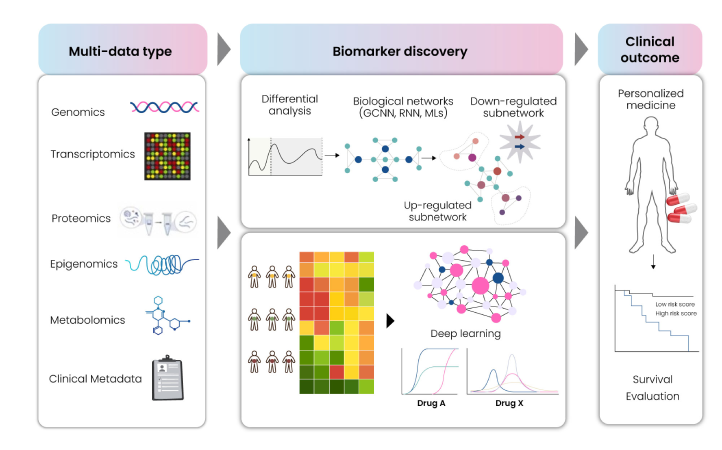
Fig 15: DL-based ensemble workflow for Biomarker Discovery
Conclusion/Outlook
生産性の観点ではバイオファーマ業界には好不調の波があり、前臨床試験を経ても臨床試験の失敗率は 90 % 超、新薬開発コストは $2.6 billion を上回ると報告されている(16)。こうした多数の障壁にもかかわらず、バイオマーカー探索は疾患診断と治療モニタリングにおける重要性を着実に高めている。本ホワイトペーパーでは、多様な molecular biomarkers の種類と R&D への応用トレンドを概観し、同定・選択・検証・バリデーションの各段階で data-driven アプローチを可能にする破壊的ツール/テクノロジーの前例なき有用性を詳述した。
さらに AI/ML の導入、デジタルトランスフォーメーション、倫理・規制基準の順守が融合することで、従来型および digital biomarkers を活用した precision / personalized medicine の推進と患者アウトカム向上に向けた新戦略が拓かれつつある。Generative AI(19) や large language models (LLMs)―例として ChatGPT(21)―の進化により、大規模テキストデータセットを横断的にマイニングして新規 disease-associated biomarkers を抽出し、より精緻な診断と標的治療を実現する力が AI に備わるのは必然だ。LLMs には誤情報・不正確さのリスクがあるため慎重な活用が求められるものの、バイオマーカー探索・開発を支援する利点は明確であり、precision medicine と創薬・開発・リポジショニングのイノベーション最前線に位置している(22)。このように AI/ML を活用した具体的取り組みが、ヘルスケアと研究開発における実証済みかつ実用的なソリューションの創出へ向けて着々と進行している。
References
1. Dahham Alsoud, Séverine Vermeire, Bram Verstockt. Biomarker discovery for personalized therapy selection in inflammatory bowel diseases: Challenges and promises, Current Research in Pharmacology and Drug Discovery, Volume 3, 2022, 100089, ISSN 2590-2571, https://doi.org/10.1016/j.crphar.2022.100089
2. Biomarkers Market Size, Share & Trends Analysis Report. Report ID: 978-1-68038-979-1: https://www.grandviewresearch.com/industry-analysis/biomarkers-industry
3. Attila A. Seyhan. Biomarkers in drug discovery and development. 2010: https://www.europeanpharmaceuticalreview.com/article/4357/biomarkers-drug-discovery-development/
4. Califf RM. Biomarker definitions and their applications. Exp Biol Med (Maywood). 2018 Feb;243(3):213-221. doi: 10.1177/1535370217750088. PMID: 29405771
5. Landry, Vivianne & Coburn, Patrick & Kost, Karen & Liu, Xinyu & Li-Jessen, Nicole. (2022). Diagnostic Accuracy of Liquid Biomarkers in Airway Diseases: Toward Point-of-Care Applications. Frontiers in Medicine. 9. 10.3389/fmed.2022.855250
6. Paweletz CP, Andersen JN, Pollock R, Nagashima K, Hayashi ML, Yu SU, et al. (2011) Identification of Direct Target Engagement Biomarkers for Kinase-Targeted Therapeutics. PLoS ONE 6(10): e26459. https://doi.org/10.1371/journal.pone.0026459
7. Tang et al., Use of in vivo animal models to assess pharmacokinetic drug-drug interactions, Pharm Res., 2010, 27(9), 1772-1787
8. Storey et al., A Structured Approach to Optimizing Animal Model Selection for Human Translation: The Animal Model Quality Assessment., ILAR J, 2021, 62(1-2), 66-76
9. Long et al., Drug discovery oncology in a mouse: concepts, models and limitations, Future Sci OA., 2021, 7(8)
10. Vasudevan, S., Saha, A., Tarver, M.E. et al. Digital biomarkers: Convergence of digital health technologies and biomarkers. npj Digit. Med. 5, 36 (2022). https://doi.org/10.1038/s41746-022-00583-z
11. Digital Medicine Society: https://dimesociety.org/
12. Bent B, Wang K, Grzesiak E, Jiang C, Qi Y, Jiang Y, Cho P, Zingler K, Ogbeide FI, Zhao A, Runge R, Sim I, Dunn J. The digital biomarker discovery pipeline: An open-source software platform for the development of digital biomarkers using mHealth and wearables data. J Clin Transl Sci. 2020 Jul 14;5(1): e19. doi: 10.1017/cts.2020.511. PMID: 33948242
13. Cui W, Duan Z, Li Z, Feng J. Assessment of Alzheimer’s disease-related biomarkers in patients with obstructive sleep apnea: A systematic review and meta-analysis. Front Aging Neurosci. 2022 Oct 13;14:902408. doi: 10.3389/fnagi.2022.902408. PMID: 36313031
14. Scaros O, Fisler R. Biomarker technology roundup: from discovery to clinical applications, a broad set of tools is required to translate from the lab to the clinic. Biotechniques. 2005 Apr; Suppl:30-2. doi: 10.2144/05384su01. PMID: 16528921
15. Zhang X, Jonassen I, Goksøyr A. Machine Learning Approaches for Biomarker Discovery Using Gene Expression Data. In: Helder I. N, editor. Bioinformatics [Internet]. Brisbane (AU): Exon Publications; 2021 Mar 20. Chapter 4. PMID: 33877765
16. Zhavoronkov A. Artificial Intelligence for Drug Discovery, Biomarker Development, and Generation of Novel Chemistry. Mol. Pharmaceutics 2018, 15, 10, 4311–4313. Publication Date:October 1, 2018. https://doi.org/10.1021/acs.molpharmaceut.8b00930
17. Ng, S., Masarone, S., Watson, D. et al. The benefits and pitfalls of machine learning for biomarker discovery. Cell Tissue Res 394, 17–31 (2023). https://doi.org/10.1007/s00441-023-03816-z
18. Dhillon, Arwinder & Singh, Ashima. (2018). Biology and Today’s World Machine Learning in Healthcare Data Analysis: A Survey. 10.15412/J.JBTW.01070206
19. Generative AI in healthcare & life sciences – revolutionizing healthcare through AI-powered innovation: https://www.linkedin.com/pulse/generative-ai-healthcare-life-sciences-revolutionizing-through-lhj4c
20. Elsborg J, Salvatore M. Using LLMs and Explainable ML to Analyze Biomarkers at Single-Cell Level for Improved Understanding of Diseases. Biomolecules. 2023 Oct 12;13(10):1516. doi: 10.3390/biom13101516. PMID: 37892198
21. Dipesh Uprety MD, Dongxiao Zhu PhD, Howard (Jack) West MD. ChatGPT—A promising generative AI tool and its implications for cancer care. Cancer. 14 May 2023. https://doi.org/10.1002/cncr.34827
22. Cascella M, Montomoli J, Bellini V, Bignami E. Evaluating the Feasibility of ChatGPT in Healthcare: An Analysis of Multiple Clinical and Research Scenarios. J Med Syst. 2023 Mar 4;47(1):33. doi: 10.1007/s10916-023-01925-4. PMID: 36869927





%20%20%E3%82%92%E6%AE%B5%E9%9A%8E%E7%9A%84%E3%81%AB%E8%A7%A3%E8%AA%AC.png?width=750&name=Targeted%20Protein%20Degradation(TPD)%20%20%E3%82%92%E6%AE%B5%E9%9A%8E%E7%9A%84%E3%81%AB%E8%A7%A3%E8%AA%AC.png)












